அத்தியாயம் 8 : அயனிச் சமநிலை - Online Test
pH = – log10[H+]
[H+] = 10–pH
கன அளவு x mL என கருதுக
V1M1 + V2M2
+ V3M3 =VM
xmL of 10–1 M + xmL of 10–2
M + xmL of 10–3 M
= 3x mL of [H+]
ஃ[H+] = x[0.1 + 0.01 +
0.001] / 3x
= (0.1 + 0.01 + 0.001) / 3
= (0.111 / 3) = 0.037 ⇒ 3.7 × 10–2
0.1 M NaCl கரைசலில், கரைதிறன் பெருக்க மதிப்பு 1.6 × 10–10 கொண்ட AgCl(s) திண்மத்தின் கரைதிறன் மதிப்பு
AgCl(s) ⇌ Ag+(aq) + Cl–(aq)
NaCl → Na+ + Cl–
0.01M 0.01M
0.01M
Ksp = 1.6 × 10–10
Ksp = [Ag+][Cl–]
Ksp = (s) (s+0.1)
0.1 >>>s
ஃ s+0.1 = 0.1
ஃ S = (1.6 × 10–10 ) / (0.1) = 1.6 ×
10–9
PbI2(s) ⇌ Pb2+(aq) + 2I–(aq)
Ksp = (s) (2s)2
3.2 × 10–8 = 4s3
s = (3.2 × 10–8) / (4)1/3
= (8 × 10–9)1/3 = 2 × 10–3M
அறைவெப்பநிலையில் MY மற்றும் NY3, ஆகிய
கரையாத உப்புகள் 6.2 × 10–13 என்ற சமமான, Ksp மதிப்புகளை கொண்டுள்ளன. MY மற்றும் NY3 ஆகியவற்றைப்
பொறுத்தவரையில் எந்த கூற்று உண்மையானது?
KY உப்பு சேர்ப்பதால் CY [Y–] பொது அயனியை கொண்டது. பொது அயனிவிளைவின் காரணமாக MY மற்றும் NY3 ஆகியவைகளின் கரைதிறனைக் குறைக்கிறது. எனவே வாய்ப்பு (அ/A) மற்றும் (ஆ/B) தவறு
MY உப்பிற்கு, MY ⇌ M+ + Y–
Ksp = (s) (s)
6.2 × 10–13 = s2
NY3,உப்பினில்
MY ⇌ M+ + Y–
Ksp = (s) (3s)3
Ksp = 27s4
s = (6.2 × 10–13) / (27)1/4
s = 10–4
நீரில் MY யின் மோலார் கரைதிறனானது NY3 யைவிட குறைவு
x ml 0.1 m NaOH + x ml of 0.01 M HCl
NaOHன் மோல்களின் எண்ணிக்கை = 0.1 × x × 10–3 = 0.1x
× 10–3
HCl ன் மோல்களின் எண்ணிக்கை = 0.1 × x × 10–3 = 0.01x
× 10–3
கலந்த பின் NaOHன் மோல்களின் எண்ணிக்கை = 0.1x × 10–3 – 0.01x
× 10–3 = 0.09x × 10–3
NaOHன் செறிவு = (0.09x × 10–3) / (2x × 10–3) = 0.045
[OH–] = 0.045
pOH = –log(4.5 × 10–2)
= 2 – log 4.5
= 2 – 0.65 = 1.35
pH = 14 = 1.35 = 12.65
ஒரு வலிமை குறைந்த அமிலத்தின் பிரிகை மாறிலி மதிப்பு 1 × 10–3 pH = 4 எனும் மதிப்பு கொண்ட ஒரு தாங்கல் கரைசலை தயாரிக்க தேவையான
[அமிலம்)/ [உப்பு] = விகிதம்
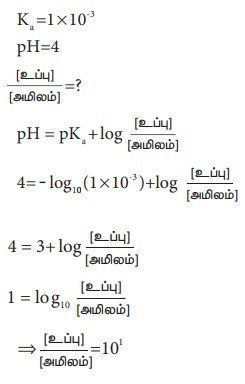
[அமிலம்)/ [உப்பு] = 1/ 10
1:10
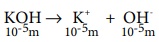
[OH–] = 10–5 M
pH = 14 = POH
pH = 14 – (–log[OH–]
= 14 + log[OH–]
= 14 + log10–5 ⇒ = 14 – 5 ⇒ = 9

HPO42– ஆனது ஒரு புரோட்டானை ஏற்று H2PO4– ஐ உருவாக்கும்.
அது ஒரு புரோட்டானை இழக்கும் போது PO43– உருவாகும்.
pH = – log1o[H+]
[H+] = 10–pH
= 100 = 1
[H+] =1M
இக்கரைசல் வலிமைமிகு அமிலமாகும்