அலகு 9 : கரைசல்கள் - Online Test
ஒரு கரைசலின், செறிவிற்கு (செறிவு அலகு mol L‒1) எதிரான சவ்வூடு பரவல் அழுத்தம் (π) வரைபடம் நேர்க்கோட்டை தருகிறது. இதன் சாய்வு 310R. இங்கு 'R' என்பது வாயு மாறிலி. சவ்வூடுபரவல் அழுத்தம் அளவிடப்பட்ட வெப்பநிலையின் மதிப்பு
π = CRT
y = x(m)
m = RT
310 R = RT
ஃ
T = 310 K = 37oC
200 mL புரதநீர்க் கரைசலானது, 1.26g புரதத்தை கொண்டுள்ளது. 300K வெப்பநிலையில், இந்த கரைசலின் சவ்வூடுபரவல் அழுத்த மதிப்பு 2.52 × 10‒3 bar என கண்டறியப்பட்டுள்ளது. புரதத்தின் மோலார் நிறை (R =
0.083 L bar mol‒1K‒1)
π = CRT
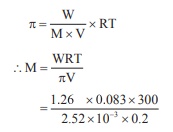
= 62250 g mol‒1 = 62.22
Kg mol‒1
வலிமைமிகு மின்பகுளியான பேரியம் ஹைட்ராக்சைடின் நீர்த்த நீர்க்கரைசலுக்கு வாண்ட் ஹாஃப் காரணி (i) மதிப்பு
Ba(OH)2 → Ba2+
+ 2OH‒
Ba(OH)2 பிரிகையடைந்து
Ba2+ மற்றும் 2OH– அயனிகளைத் தருகிறது
n = 3 அயனிகள்
α ≈ l Ba (OH)2 வலிமை மிகு மின்பகுளி
α = (i – l) / n – l
i = α (n – 1) + 1 = 1 (3 – l) + l =
1 (2) + l = 3
10% w/w செறிவுடைய சோடியம் ஹைட்ராக்சைடு நீர்க்கரைசலின் மோலாலிட்டி என்ன?
10% W/W என்பது 100g கரைசலில் 10g சோடியம் ஹைட்ராக்சைடு உள்ளதைக் குறிக்கிறது.

M2 (NaOH) = 40g mol‒1
w2 = 10g ; w1 =
100 g = 0.1 Kg;
m = n2/w1 = n2/
M2W1(கி.கி)
= 10/ 40 × 0.1 = 2.5m
கரைசலில் n கரைப்பான் மூலக்கூறுகள் ஒன்றிணையும்போது, இணைதல் வீதத்திற்கான சரியான சமன்பாடு
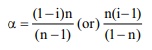
பின்வருவனவற்றுள் எந்த நீர்க்கரைசல், அதிக கொதிநிலையைக் கொண்டுள்ளது?
Na3PO4 ன் கொதிநிலை ஏற்றம் அதிகம் (அயனிகள் எண்ணிக்்ககை 4 ; 3 Na+, PO43–)
Na3PO4 → 3Na+
+ PO43‒
n = 4 அயனிகள்.
ஒரே
செறிவினை கொண்ட
வெவ்வேறு கரைசல்களில் அயனிகளின் எண்ணிக்கை அதிகம்
உள்ள
கரைசலின் கொதிநிலை ஏற்றம்
அதிகம்.
எனவே
அதன்
கொதிநிலையும் அதிகம்.
நீரின் உறைநிலைத் தாழ்வு மாறிலி மதிப்பு 1.86 K
Kgmol‒1 . 45 கிராம் நீரில், 5g Na2SO4 ஐ கரைக்கும்போது, உறைநிலையில் ஏற்படும் தாழ்வு 3.64oC.
Na2SO4 இன் வாண்ட் ஹாஃப் காரணி மதிப்பு
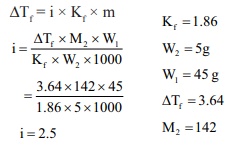
i = 2.5
சமமோலார் NaCl மற்றும் KCl கரைசல்கள் தயாரிக்கப்பட்டன. NaCl கரைசலின் உறைநிலை −2°C,எனில் KCl கரைசலின் எதிர்பார்க்கப்படும் உறைநிலை மதிப்பு
சம மோலால் KCl நீர்க்கரைசலும் 2°C உறைநிலைத்தாழ்வைக் காட்டுகிறது.
செறிவும், அயனிகளின் எண்ணிக்கையும் சமமாக
உள்ள
கரைசல்களின் உறைநிலை தாழ்வும் சமம்.
எனவே
அவற்றின் நீர்கரைசல்களின் உறை
நிலையும் சமம்.
வாண்ட் ஹாஃப் காரணி மதிப்பு 0.54 கொண்ட பென்சீனில், பீனால் மூலக்கூறுகள் இரட்டையாகின்றன. இணைதல் வீதம் என்ன?
i = 0.54 ; n = 2 ; α = ?
α = (l – i)n / (n
– 1) = (1 – 0.54)2 / (2 – 1)
α = 0.46 × 2 = 0.92
கூற்று: ஒரு நல்லியல்பு கரைசலானது ரௌல்ட் விதிக்கு கீழ்படிகிறது.
காரணம் : ஒரு நல்லியல்பு கரைசலில், கரைப்பான் ‒ கரைப்பான் இடையீடுகள் மற்றும், கரைபொருள் ‒ கரைபொருள் இடையீடுகள், ஆகியன கரைபொருள் ‒ கரைப்பான் இடையீடுகளை ஒத்துள்ளன.