அலகு 7 : வெப்ப இயக்கவியல் - Online Test
Al2O3
மற்றும் Cr2O3 ஆகியவற்றின் உருவாதல் என்தால்பி மதிப்புகள் முறையே ‒1596 kJ மற்றும் –1134 kJ, எனில் 2Al + Cr2O3 → 2Cr + Al2O3
என்ற வினைக்கு ΔH மதிப்பு
2Al + Cr2O3 →
2Cr + Al2O3
∆Hr0 = [2 ∆Hf(Cr)
+ ∆Hf (Al2O3)] − [2∆Hf (Al) + ∆Hf
(Cr2O3)]
∆Hr0 = [0 +
(−1596KJ)] − [0 + (−1134)]
∆Hr0 = −1596KJ
+ 1134 KJ
∆Hr0 = −462KJ
பின்வருவனவற்றுள் எது வெப்ப இயக்கவியல் சார்பு அல்ல?
ஒரு மூடிய கலனில், ஒரு மோல் அமோனியா மற்றும் ஒரு மோல் ஹைட்ரஜன் குளோரைடு கலக்கப்பட்டு அமோனியம் குளோரைடு உருவாக்கப்பட்டால் இவ்வினையில்
ஒரு அமைப்பின் மீது 4kJ அளவு வேலை செய்யப்படுகிறது, மேலும் 1 kJ அளவு வெப்பமானது அமைப்பினால் வெளியேற்றப்படுகிறது எனில், அக ஆற்றலில் ஏற்படும் மாற்றம்
∆U = q + w
∆U = − 1kJ + 4kJ
∆U = +3kJ
25°C வெப்பநிலையில், திறந்த முகவையில் உள்ள ஹைட்ரோ குளோரிக் அமிலத்துடன், 55.85 கிராம் இரும்பு (மோலார் நிறை 55.85 கிராம் மோல்‒1) வினைப்பட்டு வெளியேறும் ஹைட்ரஜன் வாயுவினால் செய்யப்பட்ட வேலை
Fe + 2HCl → FeCl2 + H2
ஒரு
மோல்
இரும்பு 1 மோல்
ஹைட்ரஜன் வாயுவை
வெளியேற்றுகிறது.
55.85 கி இரும்பு = 1மோல்
இரும்பு
∴ n = 1
T = 25°C = 298K
w = −P∆V
w = −P [nRT/P]
w = −nRT
w = −1 × 8.314 × 298J
w = −2477.57J
w = −2.48kJ
2 மோல்கள் நல்லியல்பு ஓரணு வாயுவை மாறா அழுத்தத்தில் 125° C லிருந்து 25° C க்கு குளிர்விக்கும்போது ΔHன் மதிப்பு [ கொடுக்கப்பட்டது CP = (5 / 2) R ]
Ti = 125 °C = 398K
Tf = 25°C = 298K
∆H = nCp(Tf −
Ti)
∆H = 2 × 5/2 R(298 − 398)
∆H = −500R
C (g) + O2
(g) → CO2 (g) ΔH° = ‒ a kJ; 2CO (g) + O2 (g) → 2CO2
(g) ΔH° = ‒ b kJ; எனில் C(g) +
1/2 O2 (g) → CO (g) என்ற வினைக்கு ΔH0 மதிப்பு
C + O2 → CO2 ∆H0
= − a kJ …........(i)
2CO + O2 → 2CO2
∆H0 = −b kJ......(ii))
C + ½ O2 → CO ∆H0
= ?
(i) × 2
2C + 2O2 → 2CO2
∆H0 = −2a kJ....(iii)
சமன்பாடு (ii) ஐ
திருப்பி எழுதுக
2CO2 → 2CO + O2
∆H0 = + b kJ.....(iv)
(iii) + (iv),
2C + O2 → 2CO ∆H0
= b − 2a kJ.....(v)
(v) + 2
C + O2 → CO ∆H0
= (b − 2a)/2 kJ
0°C வெப்பநிலை மற்றும் 1 atm அழுத்தத்தில் 15.68 L மீத்தேன் மற்றும் புரப்பேன் கலந்த வாயுக்கலவையை முற்றிலுமாக எரிக்க, அதே வெப்ப அழுத்தநிலையில் 32 L ஆக்ஸிஜன் தேவைப்படுகிறது, எனில் இந்த எரிதல் வினையில் வெளிப்படும் வெப்பத்தின் அளவு kJ அலகில்.
கொடுக்கப்பட்டவை
AHC(CH4) = ‒890
kJ mol−1
∆HC(C3H8)
= ‒2220 kJ mol−1
கலவையானது x லிட்டர் மீத்தேனையும் (15.68 − x) லிட்டர் புரப்பேனையும் கொண்டு
இருப்பதாகக் கருதுக.
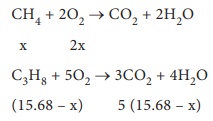
வினைப்பட்ட ஆக்சிஜனின் கனஅளவு
= 2x + 78.4 – 5x = 32 லிட்டர்
78.4 – 3x = 32
3x = 46.4 லிட்டர்
x = 15.47 லிட்டர்
கொடுக்கப்பட்டுள்ள கலவையானது 15.47 லிட்டர் மீத்தேனையும் 0.213 லிட்டர் புரப்பேனையும் கொண்டுள்ளது, எனவே

∆HC = −635.47 kJmol−1
மீத்தேன் மற்றும் ஈத்தேன் ஆகியவற்றின் பிணைப்பு பிளத்தல் ஆற்றல்கள் முறையே, 360 kJ mol‒1 மற்றும் 620 kJ mol‒1 எனில் C‒C ஒற்றை பிணைப்பின் பிளத்தல் ஆற்றல்.
4EC−H = 360 kJ mol−1
EC−H = 90 kJ mol−1
EC−C + 6 EC−H =
620 kJ mol−1
EC−C + 6 × 90 = 620 kJ
mol−1
EC−C + 540 = 620 kJ mol−1
EC−C = 80 kJ mol−1
அனைத்து வெப்பநிலைகளிலும், ஒரு தன்னிச்சையான வினைக்கு சரியான வெப்ப இயக்கவியல் நிபந்தனைகள்