அலகு 2 : அணுவின் குவாண்டம் இயக்கவியல் மாதிரி - Online Test
ஒரு துணைக்கூட்டில் உள்ள அதிகபட்சமான எலக்ட்ரான்களின் எண்ணிக்கையினை குறிப்பிடுவது
d ‒ எலக்ட்ரானுக்கான, ஆர்பிட்டால் கோண உந்த மதிப்பானது
ஆர்பிட்டால் கோண உந்த மதிப்பு = √1(1+1)h/2πd ஆர்பிட்டாலுக்கு
= √ (2×3) h/2π = √6h/2π
n = 3, l
= 1 மற்றும் m = ‒1 ஆகிய குவாண்டம் எண்களின் தொகுப்பினை அதிகபட்சமாக எத்தனை எலக்ட்ரான்கள் பெற்றிருக்க முடியும்?
n = 3; l = 1; m = −1
3px ஆகவோ அல்லது 3py ஆகவோ இருக்கலாம் அதாவது
3px அல்லது
3py−ல்
அதிகபட்சமாக இரண்டு
எலக்ட்ரான்களை மட்டுமே நிரப்ப
இயலும்.
கூற்று: 3p ஆர்பிட்டாலுக்கான ஆர மற்றும் கோண கணுக்களின் எண்ணிக்கை முறையே 1,
1
காரணம்: ஆர மற்றும் கோண கணுக்களின் எண்ணிக்கை முதன்மைக் குவாண்டம் எண்ணை மட்டுமே பொறுத்து அமையும்
ஆரக்
கணுக்களின் எண்ணிக்கை = n − l – 1
கோணக்
கணுக்களின் எண்ணிக்கை = 1
3p ஆர்பிட்டாலுக்கு ஆரக்கணுக்களின் எண்ணிக்கை = 3 – l − 1 = 1
கோணக்
கணுக்களின் எண்ணிக்கை = 1
n = 3 என்ற முதன்மைக் குவாண்டம் எண்ணை பெற்றிருக்கும் ஆர்ட்டால்களின் மொத்த எண்ணிக்கை
n = 3; l = 0; ml
= 0 − ஒரு
s ஆர்பிட்டால்கள்
n = 3; l = 1; ml
= −1, 0, 1 − மூன்று
p ஆர்பிட்டால்கள்
n = 3; l = 2; ml
= −2, −1, 0, 1, 2 − ஐந்து
d ஆர்பிட்டால்கள்
மொத்தம் ஒன்பது
ஆர்பிட்டால்கள் சாத்தியமாகும்.
n = 6 எனில், எலக்ட்ரான்கள் நிரப்பப்படும் சரியான வரிசை
n = 6 ஆஃபா தத்துவப்படி
6s → 4f → 5d→ 6p
ns → (n −2) f → (n − 1)d → np
பின்வரும் குவாண்டம் எண்களின் தொகுப்பினைக் கருதுக.
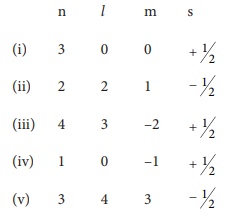
பின்வரும் எந்த
குவாண்டம் எண்களின் தொகுப்பு சாத்தியமற்றது?
(ii) l ஆனது 0 முதல் (n − 1) வரையிலான மதிப்புகளைப் பெற்றிருக்க முடியும். n = 2 சாத்தியமான '1' மதிப்புகள் 0, 1 எனவே
1 = 2 சாத்தியமற்றது.
(iv) l = 0 க்கு ; m = −1 சாத்தியமற்றது
(v) n = 3க்கு; l = 4 மற்றும் m = 3 சாத்தியமற்றது
அணு எண் 105 உடைய அணுவில் உள்ள எத்தனை எலக்ட்ரான்கள் (n + l) = 8 என்ற மதிப்பினை பெற்றிருக்க முடியும்
n + 1 = 8 அணு எண் 105 உடைய
தனிமத்தின் எலக்ட்ரான் அமைப்பு [Rn] 5f14 6d37s2
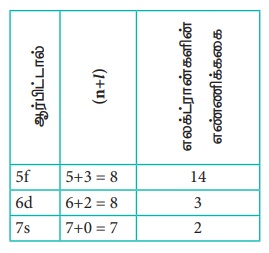
எலக்ட்ரான்களின் எண்ணிக்கை = 14 + 3 = 17
3dxy
ஆர்பிட்டாலில் yz தளத்தில் எலக்ட்ரான் அடர்த்தி
நிலை மற்றும் உந்தத்தின் நிச்சயமற்றத் தன்மை சமம் எனில், அதன் திசைவேகத்தின் குறைந்தபட்ச நிச்சயமற்றத் தன்மை