அலகு 2 : அணுவின் குவாண்டம் இயக்கவியல் மாதிரி - Online Test
M2+ அயனியின் எலக்ட்ரான் அமைப்பு 1s2
2s2 2p6 3s2 3p6 3d6 அதன் அணு நிறை 56 எனில் M என்ற அணுவின் அணுக்கரு பெற்றிருக்கும் நியூட்ரான்களின் எண்ணிக்கை
M2+ :1s2 2s2
2p6 3s2 3p6 3d6
M :1s2 2s2 2p6
3s2 3p6 3d8
அணு
எண்
= 26;
நிறை
எண்
= 56
நியூட்ரான்களின் எண்ணிக்கை = 56 − 26 = 30.
45 nm அலைநீளம் உடைய ஒளியின் ஆற்றல்
E = hv = hc/ λ
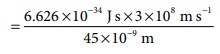
= 4.42 × 10−18 J
இரு கதிர்வீச்சின் ஆற்றல்கள் E1
மற்றும் E2 முறையே 25 eV மற்றும் 50 eV அவைகளின் அலைநீளங்கள் λ1 மற்றும் λ2 ஆகியவற்றிற்கு இடையேயானத் தொடர்பு
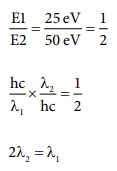
மின்புலத்தில் நிறமாலைக் கோடுகள் பிரிகையடையும் விளைவு
காந்தப்புலத்தில் நிறமாலைக் கோடுகள் பிரிகையடைவது சீமன்
விளைவு
எனவும்
மின்புலத்தில் நிறமாலைக்கோடுகள் பிரிகையடைவது ஸ்டார்க் விளைவு
எனவும்
அழைக்கப்படுகிறது
E = ‒2.178
× 10‒18 J (z2 / n2) என்ற சமன்பாட்டின் அடிப்படையில், சில முடிவுகள் தரப்பட்டுள்ளன. அவற்றுள் சரியாக இல்லாதது எது?
சரியான
கூற்று
: n = 6 வட்டப்பாதையில் இருப்பதைக் காட்டிலும் n = 1ல்
எலக்ட்ரானானது அதிக
எதிர்குறி ஆற்றலைப் பெற்றிருக்கும். இது
எலக்ட்ரானானது சிறிய
அனுமதிக்கப்பட்ட ஆர்பிட்டில் உள்ள
போது
அதிக
வலிமையுடன் பிணைக்கப்பட்டுள்ளது என
பொருள்படும்.
போர் அணுக்கொள்கையின் அடிப்படையில், ஹைட்ரஜன் அணுவில் பின்வரும் எந்தப் பரிமாற்றம் குறைவான ஆற்றலுடைய போட்டானைத் தரும்.
n = 6 to n = 5
E6 = −13.6 / 62;
E5 = −13.6 / 52
E6 – E5 =
(−13.6/62) − (−13.6/52)
= 0.166 eV atom−1
E5 – E4 =
(−13.6/52) − (−13.6/ 42)
= 0.306 ev atom−1
கூற்று: He+ ன் நிறமாலையானது, ஹைட்ரஜனின் நிறமாலையினை ஒத்திருக்கும்.
காரணம்: He+ ம் ஒரு எலக்ட்ரானைக் கொண்ட ஒரு அமைப்பாகும்.
பின்வரும் d ஆர்பிட்டால் இணைகளில் எலக்ட்ரான் அடர்த்தியினை அச்சுகளின் வழியே பெற்றிருப்பது எது?
தற்சுழற்சி குவாண்டம் எண்
முதலாவது எலக்ட்ரானுக்கு ms = + 1/2
இரண்டாவது எலக்ட்ரானுக்கு ms = − 1/2
Eu (அணு எண் 63), Gd (அணு எண் 64) மற்றும் Tb (அணு எண் 65) ஆகியவற்றின் எலக்ட்ரான் அமைப்புகள் முறையே
Eu: [Xe] 4f7 , 5d0 ,
6s2
Gd: [Xe] 4f7 , 5d1 ,
6s2
Tb: [Xe] 4f9 , 5d0 ,
6s2