Я«ЁЯ«▓Я«ЋЯ»Ђ 1 : Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я«┐Я«ЕЯ»Ї Я«ЁЯ«ЪЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ«░Я»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«хЯ»ЄЯ«цЯ«┐Я«ЋЯ»Ї Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ»ђЯ«ЪЯ»ЂЯ«ЋЯ«│Я»Ї - Online Test
Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«јЯ«цЯ»Ђ Я«хЯ«┐Я«ЋЯ«┐Я«цЯ«џЯ»ЇЯ«џЯ«┐Я«цЯ»ѕЯ«хЯ»Ђ Я«хЯ«┐Я«ЕЯ»ѕ?
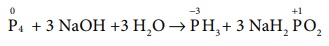
Я«ЋЯ«ЙЯ«░ Я«іЯ«ЪЯ«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї Я«фЯ»іЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«џЯ«┐Я«»Я««Я»Ї Я«фЯ»єЯ«░Я»ЇЯ««Я«ЙЯ«ЎЯ»ЇЯ«ЋЯ«ЕЯ»ЄЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«ЕЯ»Ї Я«џЯ««Я«ЙЯ«Е Я«еЯ«┐Я«▒Я»ѕ Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»Ђ
(MnO4Рђњ
+ 2 H2O + 3eРђњ Рєњ MnO2 + 4 OHРђњ)
Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я«┐Я«»Я«ЙЯ«Е (MnOРѕњ4) Я«єЯ«ЕЯ«цЯ»Ђ Я«њЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«ЅЯ«ЪЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ
Я««Я»ѓЯ«ЕЯ»ЇЯ«▒Я»Ђ
Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЈЯ«▒Я»ЇЯ«▒Я»ЂЯ«ЋЯ»Ї Я«ЋЯ»іЯ«│Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«јЯ«ЕЯ«хЯ»Є
Я«џЯ««Я«ЙЯ«ЕЯ«еЯ«┐Я«▒Я»ѕ
= (KMnO4 Рѕњ Я«ЕЯ»Ї Я««Я»ІЯ«▓Я«ЙЯ«░Я»ЇЯ«еЯ«┐Я«▒Я»ѕ) / 3
= 158.1 / 3 = 52.7
Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ«хЯ«ЕЯ«хЯ«▒Я»ЇЯ«▒Я»ЂЯ«│Я»Ї, 180 g Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│Я«цЯ»Ђ Я«јЯ«цЯ»Ђ?
180g Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї Я«ЋЯ«ЙЯ«БЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я««Я»ІЯ«▓Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ = Я«еЯ»ђЯ«░Я«┐Я«ЕЯ»Ї
Я«еЯ«┐Я«▒Я»ѕ
/Я«еЯ»ђЯ«░Я«┐Я«ЕЯ»Ї
Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї
Я«еЯ«┐Я«▒Я»ѕ
= 180g/ 18g molРѕњ1 =10 Я««Я»ІЯ«▓Я»ЇЯ«ЋЯ«│Я»Ї
Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї
6.022 ├Ќ 1023 Я«еЯ»ђЯ«░Я»Ї
Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»ЂЯ«ЋЯ«│Я»Ї Я«ЅЯ«│Я»ЇЯ«│Я«Е.
10 Я««Я»ІЯ«▓Я»Ї Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї
6.022 ├Ќ 1023 ├Ќ 10 = 6.022 ├Ќ 1024 Я«еЯ»ђЯ«░Я»Ї Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»ЂЯ«ЋЯ«│Я»Ї Я«ЅЯ«│Я»ЇЯ«│Я«Е.
0┬░ C Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї 1 atm Я«ЁЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї 7.5g Я«хЯ«ЙЯ«»Я»Ђ 5.6 L Я«ЋЯ«ЕЯ«ЁЯ«│Я«хЯ»ѕ Я«ЁЯ«ЪЯ»ѕЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ»іЯ«│Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ Я«јЯ«ЕЯ«┐Я«▓Я»Ї, Я«ЁЯ«еЯ»ЇЯ«ц Я«хЯ«ЙЯ«»Я»Ђ
273K Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї 1 atm Я«ЁЯ«┤Я»ЂЯ«цЯ»ЇЯ«цЯ«цЯ»ЇЯ«цЯ«┐Я«▓Я»Ї 7.5g Я«хЯ«ЙЯ«»Я»Ђ
Я«ЁЯ«ЪЯ»ѕЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»Ї Я«ЋЯ»іЯ«│Я»ЇЯ«│Я»ЂЯ««Я»Ї Я«ЋЯ«ЕЯ«ЁЯ«│Я«хЯ»Ђ
5.6 Я«▓Я«┐Я«ЪЯ»ЇЯ«ЪЯ«░Я»Ї Я«јЯ«ЕЯ«хЯ»Є,
22.4 Я«▓Я«┐Я«ЪЯ»ЇЯ«ЪЯ«░Я»Ї Я«ЋЯ«ЕЯ«ЁЯ«│Я«хЯ»ѕ
Я«ЁЯ«ЪЯ»ѕЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»Ї Я«ЋЯ»іЯ«│Я»ЇЯ«│Я»ЂЯ««Я»Ї Я«хЯ«ЙЯ«»Я»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«еЯ«┐Я«▒Я»ѕ
= 7.5g/5.6L x 22.4L = 30g
NOРѕњ Я«ЕЯ»Ї Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї
Я«еЯ«┐Я«▒Я»ѕ
(14 + 16) = 30g
1.7 g Я«ЁЯ««Я»ЇЯ««Я»ІЯ«ЕЯ«┐Я«»Я«ЙЯ«хЯ«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ
Я«њЯ«░Я»Ђ
Я«ЁЯ««Я»ЇЯ««Я»ІЯ«ЕЯ«┐Я«»Я«Й (NH3) Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я«┐Я«▓Я»Ї Я«ЋЯ«ЙЯ«БЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ (7 + 3) = 10
Я«ЁЯ««Я»ЇЯ««Я»ІЯ«ЕЯ«┐Я«»Я«Й Я««Я»ІЯ«▓Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ = Я«еЯ«┐Я«▒Я»ѕ /Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї Я«еЯ«┐Я«▒Я»ѕ = 1.7g /17gmolРѕњ1
= 0.1mol
0.1Я««Я»ІЯ«▓Я»Ї Я«ЁЯ««Я»ЇЯ««Я»ІЯ«ЕЯ«┐Я«»Я«ЙЯ«хЯ«┐Я«▓Я»Ї Я«ЋЯ«ЙЯ«БЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»ЂЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ = 0.1 ├Ќ 6.022 ├Ќ 1023 = 6.022 ├Ќ 1022
0.1 Я««Я»ІЯ«▓Я»Ї Я«ЁЯ««Я»ЇЯ««Я»ІЯ«ЕЯ«┐Я«»Я«ЙЯ«хЯ«┐Я«▓Я»Ї Я«ЋЯ«ЙЯ«БЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ = 10 ├Ќ 6.022 ├Ќ 1022 = 6.022 ├Ќ 1023
SO42Рђњ,
SO32Рђњ, S2O42Рђњ, S2O62Рђњ
Я«єЯ«ЋЯ«┐Я«» Я«јЯ«цЯ«┐Я«░Я«»Я«ЕЯ«┐Я«ЋЯ«│Я«┐Я«▓Я»Ї Я«џЯ«▓Я»ЇЯ«фЯ«░Я«┐Я«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЁЯ«ЪЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«џЯ«░Я«┐Я«»Я«ЙЯ«Е Я«ЈЯ«▒Я»ЂЯ«хЯ«░Я«┐Я«џЯ»ѕ Я«јЯ«цЯ»Ђ?
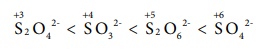
Я«фЯ»єЯ«░Я»ЇЯ«░Я«ИЯ»Ї Я«єЯ«ЋЯ»ЇЯ«џЯ«▓Я»ЄЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«ЕЯ»Ї Я«џЯ««Я«ЙЯ«Е Я«еЯ«┐Я«▒Я»ѕ

Я«ЁЯ«хЯ«ЋЯ«ЙЯ«ЪЯ»ЇЯ«░Я»І Я«јЯ«БЯ»Ї Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»Ђ 6.022 ├Ќ 1023 Я«▓Я«┐Я«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ 6.022 ├Ќ 1020 Я«ЋЯ»ЇЯ«ЋЯ»Ђ Я««Я«ЙЯ«▒Я»ЇЯ«▒Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«цЯ«ЕЯ«ЙЯ«▓Я»Ї Я««Я«ЙЯ«▒Я»ЂЯ«хЯ«цЯ»Ђ
22.4 L Я«ЋЯ«ЕЯ«ЁЯ«│Я«хЯ»Ђ Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я«ЄЯ«░Я»Ђ Я«ЋЯ»іЯ«│Я»ЇЯ«ЋЯ«▓Я«ЕЯ»ЇЯ«ЋЯ«│Я»Ї A Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї B Я«»Я«┐Я«▓Я»Ї Я««Я»ЂЯ«▒Я»ѕЯ«»Я»Є 8g O2 Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї 8g SO2 Я«хЯ«ЙЯ«»Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»Ї STP Я«еЯ«┐Я«▓Я»ѕЯ«»Я«┐Я«▓Я»Ї Я«еЯ«┐Я«░Я«ЪЯ»ЇЯ«ЪЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ. Я«јЯ«ЕЯ«┐Я«▓Я»Ї
Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ«┐Я«ЕЯ»Ї Я««Я»ІЯ«▓Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ = 8g/32g
= 0.25 Я««Я»ІЯ«▓Я»ЇЯ«ЋЯ«│Я»Ї
Я«џЯ«▓Я»ЇЯ«фЯ«░Я»Ї
Я«ЪЯ»ѕ
Я«єЯ«ЋЯ»ЇЯ«ИЯ»ѕЯ«ЪЯ«┐Я«ЕЯ»Ї Я««Я»ІЯ«▓Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ = 8g/ 64g
= 0.125 Я««Я»ІЯ«▓Я»ЇЯ«ЋЯ«│Я»Ї
Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»ЂЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕЯ«ЋЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«ЄЯ«ЪЯ»ѕЯ«»Я»ЄЯ«»Я«ЙЯ«Е Я«хЯ«┐Я«ЋЯ«┐Я«цЯ««Я»Ї = 0.25 : 0.125 = 2 : 1
50 mL 8.5
% AgNO3 Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ѕ 100 mL. 1.865% Я«фЯ»іЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«џЯ«┐Я«»Я««Я»Ї Я«ЋЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ Я«ЋЯ«┐Я«ЪЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«хЯ»ђЯ«┤Я»ЇЯ«фЯ«ЪЯ«┐Я«хЯ«┐Я«ЕЯ»Ї Я«јЯ«ЪЯ»ѕ Я«јЯ«ЕЯ»ЇЯ«Е?
AgNO3 + KCl Рєњ KNO3
+ AgCl
50 mL 8.5% Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»Ї Я«єЯ«ЕЯ«цЯ»Ђ 4.25g AgNO3 РѕњЯ«љЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ. 50 mL 8.5% AgNO3 Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│
AgNO3 Я«ЕЯ»Ї
Я««Я»ІЯ«▓Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ = Я«еЯ«┐Я«▒Я»ѕ
/ Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї
Я«еЯ«┐Я«▒Я»ѕ
= 4.25/170 = 0.025 Я««Я»ІЯ«▓Я»ЇЯ«ЋЯ«│Я»Ї
Я«ЄЯ«цЯ»ѕЯ«фЯ»ЇЯ«фЯ»ІЯ«▓Я«хЯ»Є, 100 mL 1.865% KCl Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«▓Я»Ї Я«ЋЯ«ЙЯ«БЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї KCl Я«ЕЯ»Ї
Я««Я»ІЯ«▓Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ = 1.865 / 74.5
= 0.025 Я««Я»ІЯ«▓Я»ЇЯ«ЋЯ«│Я»Ї
Я«јЯ«ЕЯ«хЯ»Є
Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї AgCl Я«ЕЯ»Ї
Я««Я»іЯ«цЯ»ЇЯ«ц
Я«ЁЯ«│Я«хЯ»Ђ
0.025 Я««Я»ІЯ«▓Я»ЇЯ«ЋЯ«│Я»Ї (Я«хЯ»ЄЯ«цЯ«┐
Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»Ђ Я«хЯ«┐Я«ЋЯ«┐Я«цЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«ЁЯ«ЪЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ»ѕЯ«»Я«┐Я«▓Я»Ї)
0.025 Я««Я»ІЯ«▓Я»ЇЯ«ЋЯ«│Я»Ї AgCl Я«▓Я»Ї
Я«ЋЯ«ЙЯ«БЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї AgCl Рѕњ Я«ЕЯ»Ї Я«ЁЯ«│Я«хЯ»Ђ
= Я««Я»ІЯ«▓Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ ├Ќ Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї
Я«еЯ«┐Я«▒Я»ѕ
= 0.025 ├Ќ 143.5 = 3.59g