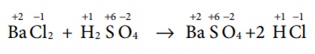Я«ЁЯ«▓Я«ЋЯ»Ђ 1 : Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я«┐Я«ЕЯ»Ї Я«ЁЯ«ЪЯ«┐Я«фЯ»ЇЯ«фЯ«ЪЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ«░Я»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«хЯ»ЄЯ«цЯ«┐Я«ЋЯ»Ї Я«ЋЯ«БЯ«ЋЯ»ЇЯ«ЋЯ»ђЯ«ЪЯ»ЂЯ«ЋЯ«│Я»Ї - Online Test
40 Я««Я«┐.Я«▓Я«┐ Я««Я»ђЯ«цЯ»ЇЯ«цЯ»ЄЯ«ЕЯ»Ї Я«хЯ«ЙЯ«»Я»ЂЯ«хЯ«ЙЯ«ЕЯ«цЯ»Ђ 80 Я««Я«┐.Я«▓Я«┐ Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«юЯ«ЕЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»Ђ Я««Я»ЂЯ«┤Я»ЂЯ««Я»ѕЯ«»Я«ЙЯ«Ћ Я«јЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЁЯ«▒Я»ѕ Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«еЯ«┐Я«▓Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«ЋЯ»ЂЯ«│Я«┐Я«░Я»ЇЯ«хЯ«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«Ъ Я«фЯ«┐Я«▒Я«ЋЯ»Ђ Я«јЯ«ъЯ»ЇЯ«џЯ«┐Я«»Я»ЂЯ«│Я»ЇЯ«│ Я«хЯ«ЙЯ«»Я»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«ЋЯ«ЕЯ«ЁЯ«│Я«хЯ»Ђ
CH4(g) + 2O2
(g) Рєњ CO2 (g) + 2 H2O (l)

Я«хЯ«┐Я«ЕЯ»ѕЯ«хЯ«┐Я«│Я»ѕЯ«фЯ»Ї Я«фЯ»іЯ«░Я»ЂЯ«ЪЯ»ЇЯ«ЋЯ«│Я»Ї Я«ЁЯ«▒Я»ѕЯ«хЯ»єЯ«фЯ»ЇЯ«ф Я«еЯ«┐Я«▓Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«ЋЯ»ЂЯ«│Я«┐Я«░Я»ЇЯ«хЯ«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ«цЯ«ЙЯ«▓Я»Ї, Я«еЯ»ђЯ«░Я»Ї Я«фЯ»єЯ«░Я»ЂЯ««Я»ЇЯ«фЯ«ЙЯ«▓Я»ЂЯ««Я»Ї Я«цЯ«┐Я«░Я«х Я«еЯ«┐Я«▓Я»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї. Я«јЯ«ЕЯ«хЯ»Є Я«хЯ«ЙЯ«»Я»ЇЯ«фЯ»ЇЯ«фЯ»Ђ (Я«Ё) Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я«џЯ«░Я«┐Я«»Я«ЙЯ«ЕЯ«цЯ»Ђ.
Я«цЯ«ЕЯ«┐Я««Я««Я»Ї X Я«ЕЯ»Ї Я«љЯ«џЯ»ІЯ«ЪЯ»ІЯ«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЄЯ«»Я»ѕЯ«фЯ»Ђ Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я«ЙЯ«▒Я»Ђ Я«ЁЯ««Я»ѕЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. 200X = 90 %, 199X
= 8 %, 202X = 2 % Я«ЄЯ«»Я«▒Я»ЇЯ«ЋЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЋЯ«┐Я«ЪЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«цЯ«ЕЯ«┐Я««Я««Я»Ї X Я«ЕЯ»Ї Я«цЯ»ІЯ«░Я«ЙЯ«» Я«ЁЯ«БЯ»Ђ Я«еЯ«┐Я«▒Я»ѕ Я««Я«цЯ«┐Я«фЯ»ЇЯ«фЯ»Ђ
(200 ├Ќ 90) + (199 ├Ќ 8) + (202 ├Ќ 2) / 100 = 199.96
= 200 u
Я«ЋЯ»ѓЯ«▒Я»ЇЯ«▒Я»Ђ (A) : Я«ЄЯ«░Я»Ђ Я««Я»ІЯ«▓Я»Ї Я«ЋЯ»ЂЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ІЯ«ИЯ«┐Я«▓Я»Ї 12.044 ├Ќ 1023 Я«ЋЯ»ЂЯ«│Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ІЯ«ИЯ»Ї Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»ЂЯ«ЋЯ«│Я»Ї Я«ЅЯ«│Я»ЇЯ«│Я«Е.
Я«ЋЯ«ЙЯ«░Я«БЯ««Я»Ї (R) : Я«њЯ«░Я»Ђ Я««Я»ІЯ«▓Я»Ї Я«ЁЯ«│Я«хЯ»ЂЯ«│Я»ЇЯ«│ Я«јЯ«еЯ»ЇЯ«ц Я«њЯ«░Я»Ђ Я«фЯ»іЯ«░Я»ЂЯ«│Я«┐Я«▓Я»ЂЯ««Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«ЅЯ«ЪЯ»ЇЯ«фЯ»іЯ«░Я»ЂЯ«ЪЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ 6.02 ├Ќ 1022
Я«џЯ«░Я«┐Я«»Я«ЙЯ«Е Я«ЋЯ«ЙЯ«░Я«БЯ««Я»Ї : Я«њЯ«░Я»Ђ Я««Я»ІЯ«▓Я»Ї Я«ЁЯ«│Я«хЯ»ЂЯ«│Я»ЇЯ«│ Я«јЯ«еЯ»ЇЯ«цЯ«хЯ»іЯ«░Я»Ђ Я«џЯ»ЄЯ«░Я»ЇЯ««Я«цЯ»ЇЯ«цЯ«┐Я«▓Я»ЂЯ««Я»Ї Я«ЁЯ«ЪЯ«ЎЯ»ЇЯ«ЋЯ«┐Я«»Я»ЂЯ«│Я»ЇЯ«│ Я«ЅЯ«ЪЯ»ЇЯ«фЯ»іЯ«░Я»ЂЯ«ЪЯ»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ 6.022 ├Ќ 1023
Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ»Ї, Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ»Ї Я««Я»ІЯ«ЕЯ«ЙЯ«ЋЯ»ЇЯ«ИЯ»ѕЯ«ЪЯ»Ђ Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ»Ї Я«ЪЯ»ѕЯ«»Я«ЙЯ«ЋЯ»ЇЯ«ИЯ»ѕЯ«ЪЯ»Ђ Я«јЯ«ЕЯ»ЂЯ««Я»Ї Я«ЄЯ«░Я«БЯ»ЇЯ«ЪЯ»Ђ Я«єЯ«ЋЯ»ЇЯ«ИЯ»ѕЯ«ЪЯ»ЂЯ«ЋЯ«│Я»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«јЯ«еЯ»ЇЯ«ц Я«цЯ«ЕЯ«┐Я««Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«џЯ««Я«ЙЯ«Е Я«еЯ«┐Я«▒Я»ѕ Я««Я«ЙЯ«▒Я«ЙЯ««Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│Я«цЯ»Ђ?
Я«хЯ«┐Я«ЕЯ»ѕ 1:
2C + O2 Рєњ 2 CO
2 ├Ќ 12g Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ«ЙЯ«ЕЯ«цЯ»Ђ 32g Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЂЯ«ЪЯ«ЕЯ»Ї Я«ЄЯ«БЯ»ѕЯ«еЯ»ЇЯ«цЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ,
Я«јЯ«ЕЯ«хЯ»Є
Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ«┐Я«ЕЯ»Ї Я«џЯ««Я«ЙЯ«Е
Я«еЯ«┐Я«▒Я»ѕ
[(2 ├Ќ 12) / 32] ├Ќ 8 = 6
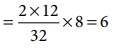
Я«хЯ«┐Я«ЕЯ»ѕ 2:
C + O2 Рєњ CO2
12g Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ«ЙЯ«ЕЯ«цЯ»Ђ 32g Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЂЯ«ЪЯ«ЕЯ»Ї Я«ЄЯ«БЯ»ѕЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЅЯ«│Я»ЇЯ«│Я«цЯ»Ђ,
Я«јЯ«ЕЯ«хЯ»Є
Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ«┐Я«ЕЯ»Ї Я«џЯ««Я«ЙЯ«Е
Я«еЯ«┐Я«▒Я»ѕ
= (12/32) ├Ќ 8 = 3
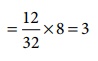
Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я««Я»ѓЯ«ЕЯ»ЇЯ«▒Я»Ђ Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ Я«ЅЯ«▓Я»ІЯ«ЋЯ«цЯ»Ї Я«цЯ«ЕЯ«┐Я««Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«џЯ««Я«ЙЯ«Е Я«еЯ«┐Я«▒Я»ѕ 9g.eqРђњ1 Я«ЁЯ«цЯ«ЕЯ»Ї Я«еЯ»ђЯ«░Я«▒Я»ЇЯ«▒ Я«єЯ«ЋЯ»ЇЯ«ИЯ»ѕЯ«ЪЯ«┐Я«ЕЯ»Ї Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»Ђ Я«еЯ«┐Я«▒Я»ѕ
Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я««Я»ѓЯ«ЕЯ»ЇЯ«▒Я»Ђ
Я«ЋЯ»іЯ«БЯ»ЇЯ«Ъ
Я«ЅЯ«▓Я»ІЯ«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»ѕ M3+ Я«јЯ«ЕЯ»ЇЯ«Ћ
Я«џЯ««Я«ЙЯ«Е
Я«еЯ«┐Я«▒Я»ѕ
= Я«ЅЯ«▓Я»ІЯ«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«еЯ«┐Я«▒Я»ѕ
/ Я«џЯ««Я«ЙЯ«Е
Я«ЋЯ«ЙЯ«░Я«БЯ«┐
9g eqРѕњ1 = Я«ЅЯ«▓Я»ІЯ«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«еЯ«┐Я«▒Я»ѕ / 3eq
Я«ЅЯ«▓Я»ІЯ«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«еЯ«┐Я«▒Я»ѕ
= 27g
Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї Я«єЯ«ЋЯ»ЇЯ«ИЯ»ѕЯ«ЪЯ»Ђ = M2O3 ;
Я«єЯ«ЋЯ»ЇЯ«ИЯ»ѕЯ«ЪЯ«┐Я«ЕЯ»Ї Я«еЯ«┐Я«▒Я»ѕ
= (2 ├Ќ 27) + (3 ├Ќ 16)
= 102g
0.018 Я«ЋЯ«┐Я«░Я«ЙЯ««Я»Ї Я«јЯ«ЪЯ»ѕЯ«»Я»ЂЯ«│Я»ЇЯ«│ Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ»ЂЯ«│Я«┐Я«»Я«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ Я«еЯ»ђЯ«░Я»Ї Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»ЂЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ
Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ»ЂЯ«│Я«┐Я«»Я«┐Я«ЕЯ»Ї Я«јЯ«ЪЯ»ѕ
= 0.018g
Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ»ЂЯ«│Я«┐Я«»Я«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│
Я««Я»ІЯ«▓Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ = Я«еЯ»ђЯ«░Я«┐Я«ЕЯ»Ї
Я«еЯ«┐Я«▒Я»ѕ
/ Я««Я»ІЯ«▓Я«ЙЯ«░Я»Ї
Я«еЯ«┐Я«▒Я»ѕ
= 0.018 / 18 = 10Рѕњ3
Я««Я»ІЯ«▓Я»Ї
1 Я««Я»ІЯ«▓Я»Ї Я«еЯ»ђЯ«░Я«┐Я«▓Я»Ї
Я«ЋЯ«ЙЯ«БЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«еЯ»ђЯ«░Я»Ї
Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»ЂЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ = 6.022 ├Ќ 1023
1 Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ»ЂЯ«│Я«┐Я«»Я«┐Я«▓Я»Ї Я«ЋЯ«ЙЯ«БЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«еЯ»ђЯ«░Я»Ї
Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»ЂЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ (10Рѕњ3 Я««Я»ІЯ«▓Я»Ї)
= 6.022 ├Ќ 10Рѕњ23 ├Ќ 10Рѕњ3
= 6.022 ├Ќ 1020
1g Я««Я«ЙЯ«џЯ»Ђ Я«ЋЯ«▓Я«еЯ»ЇЯ«ц Я««Я»єЯ«ЋЯ»ЇЯ«ЕЯ»ђЯ«иЯ«┐Я«»Я««Я»Ї Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ»ЄЯ«ЪЯ»Ї Я««Я«ЙЯ«цЯ«┐Я«░Я«┐Я«»Я»ѕ (Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«џЯ»ЇЯ«џЯ«┐Я«цЯ»ѕЯ«хЯ»Ђ Я«ЁЯ«ЪЯ»ѕЯ«»Я«ЙЯ«ц Я««Я«ЙЯ«џЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»ѕЯ«ЋЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ«цЯ»Ђ) Я««Я»ЂЯ«┤Я»ЂЯ««Я»ѕЯ«»Я«ЙЯ«Ћ Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«џЯ»ЇЯ«џЯ«┐Я«цЯ»ѕЯ«хЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я«ЅЯ«ЪЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ 0.44g Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ»ЇЯ«ЪЯ»ѕЯ«»Я«ЙЯ«ЋЯ»ЇЯ«ИЯ»ѕЯ«ЪЯ»Ђ Я«хЯ«ЙЯ«»Я»ЂЯ«хЯ»ѕ Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ««Я»ЇЯ««Я«ЙЯ«цЯ«┐Я«░Я«┐Я«»Я«┐Я«▓Я»ЂЯ«│Я»ЇЯ«│ Я««Я«ЙЯ«џЯ»Ђ Я«џЯ«цЯ«хЯ»ђЯ«цЯ««Я»Ї.
MgCO3 Рєњ MgO + CO2
РєЉ
MgCO3 : (1 ├Ќ 24) + (1 ├Ќ
12) + (3 ├Ќ 16) = 84g
CO2 : (1 ├Ќ 12) + (2 ├Ќ 16)
= 44g
100% Я«цЯ»ѓЯ«»Я»ЇЯ««Я»ѕЯ«»Я»ЂЯ«ЪЯ»ѕЯ«» 84g MgCO3 Я«єЯ«ЕЯ«цЯ»Ђ Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ
44gCO2 Я«љЯ«цЯ»Ї
Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
1g MgCO3 Я«єЯ«ЕЯ«цЯ»Ђ Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ««Я»Ї Я«фЯ»іЯ«┤Я»ЂЯ«цЯ»Ђ
0.44gCO2 Я«љЯ«цЯ»Ї
Я«цЯ«░Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«јЯ«Е
Я«ЋЯ»іЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ. Я«јЯ«ЕЯ«хЯ»Є,
84g MgCO3 Я««Я«ЙЯ«цЯ«┐Я«░Я«┐Я«»Я«┐Я«ЕЯ»ѕ Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ««Я»Ї
Я«фЯ»іЯ«┤Я»ЂЯ«цЯ»Ђ
36.96 g CO2 Я«љЯ«цЯ»Ї
Я«цЯ«░Я»ЂЯ««Я»Ї
Я««Я«ЙЯ«цЯ«┐Я«░Я«┐Я«»Я«┐Я«ЕЯ»ЂЯ«ЪЯ»ѕЯ«» Я«цЯ»ѓЯ«»Я»ЇЯ««Я»ѕЯ«цЯ»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕЯ«»Я«┐Я«ЕЯ»Ї Я«џЯ«цЯ«хЯ»ђЯ«цЯ««Я»Ї = (100% / 44g CO2) ├Ќ 36.96g CO2 = 84%
Я«Ѓ Я««Я«ЙЯ«џЯ»Ђ Я«џЯ«цЯ«хЯ»ђЯ«цЯ««Я»Ї = 16%
6.3g Я«џЯ»ІЯ«ЪЯ«┐Я«»Я««Я»Ї Я«фЯ»ѕ Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ»ЄЯ«ЪЯ»ЇЯ«ЪЯ»ѕ, 30g Я«ЁЯ«џЯ«┐Я«ЪЯ»ЇЯ«ЪЯ«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓ Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«цЯ»ЇЯ«ц Я«фЯ«┐Я«ЕЯ»ЇЯ«ЕЯ«░Я»Ї Я«јЯ«ъЯ»ЇЯ«џЯ«┐Я«»Я»ЂЯ«│Я»ЇЯ«│ Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я«┐Я«ЕЯ»Ї Я«јЯ«ЪЯ»ѕ 33g. Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«ЕЯ»ЇЯ«фЯ»ІЯ«цЯ»Ђ Я«хЯ»єЯ«│Я«┐Я«»Я»ЄЯ«▒Я«┐Я«» Я«ЋЯ«ЙЯ«░Я»ЇЯ«фЯ«ЕЯ»ЇЯ«ЪЯ»ѕЯ«»Я«ЙЯ«ЋЯ»ЇЯ«ИЯ»ѕЯ«ЪЯ«┐Я«ЕЯ»Ї Я««Я»ІЯ«▓Я»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ
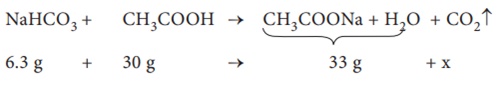
Я«хЯ»єЯ«│Я«┐Я«»Я»ЄЯ«▒Я«┐Я«» CO2 Я«ЁЯ«│Я«хЯ»Ђ x = 3.3g
Я«хЯ»єЯ«│Я«┐Я«»Я»ЄЯ«▒Я«┐Я«» CO2 Я«ЕЯ»Ї Я««Я»ІЯ«▓Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ = 3.3/44 = 0.075 Я««Я»ІЯ«▓Я»Ї
STP Я«еЯ«┐Я«▓Я»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЅЯ«│Я»ЇЯ«│ 22.4 Я«▓Я«┐Я«ЪЯ»ЇЯ«ЪЯ«░Я»Ї H2 (g) Я«хЯ«ЙЯ«»Я»Ђ, 11.2Я«▓Я«┐Я«ЪЯ»ЇЯ«ЪЯ«░Я»Ї Cl2 Я«хЯ«ЙЯ«»Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«ЋЯ«▓Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»ЇЯ«фЯ»ІЯ«цЯ»Ђ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї HCl (g) Я«хЯ«ЙЯ«»Я»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я««Я»ІЯ«▓Я»Ї Я«јЯ«БЯ»ЇЯ«БЯ«┐Я«ЋЯ»ЇЯ«ЋЯ»ѕ
H2(g) + Cl2
(g) Рєњ 2 HCl (g)
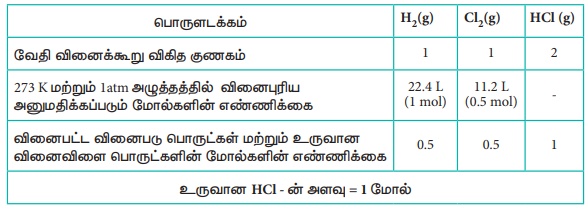
Я«џЯ»ѓЯ«ЪЯ«ЙЯ«Е Я«ЁЯ«ЪЯ«░Я»Ї Я«ЋЯ«еЯ»ЇЯ«цЯ«Ћ Я«ЁЯ««Я«┐Я«▓Я««Я»Ї Я«њЯ«░Я»Ђ Я««Я«┐Я«цЯ««Я«ЙЯ«Е Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я«┐, Я«фЯ«┐Я«ЕЯ»ЇЯ«хЯ«░Я»ЂЯ««Я»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«јЯ«цЯ»Ђ Я«єЯ«ЋЯ»ЇЯ«ИЯ«┐Я«юЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я«фЯ»Ї Я«фЯ«БЯ»ЇЯ«фЯ»ѕЯ«ЋЯ»Ї Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ«┐Я«ЪЯ«хЯ«┐Я«▓Я»ЇЯ«▓Я»ѕ?