அத்தியாயம் 9 : மின் வேதியியல் - Online Test
1F = 96500 C = 1 மோல்
எலக்ட்ரான்கள் =
6.023 × 1023e–
9650 C = (6.22 × 1023) /
(96500) × 9650 = 6.022 × 1022
பின்வரும் அரைக்கல வினைகளை கருதுக.
Mn2+ + 2e– →Mn E° = –1.18V
Mn2+ → Mn3+ +e– E° = –1.51V
3Mn2+ → Mn + 2Mn3+ என்ற வினையின் E° மதிப்பு மற்றும் முன்னோக்கு வினையின் சாத்தியக் கூறு முறையே
Mn2+ + 2e–
→ Mn (E°red) = –1.18 V
2[Mn2+ → Mn3+ + e–] (Eoox) = – 1.51 V
3Mn2+ = Mn + 2Mn3+
Eocell = ?
Eocell = (Eoox)
+ (Eored)
= – 1.51 – 1.18 = – 2.69 V
மற்றும் தன்னிச்சையானதல்ல
Eo
எதிர்
குரியானதால் ∆G நேர்க்குறி
மற்றும் முன்னோக்கு
மின்கலவினை
தன்னிச்சையானது
அல்ல
கை கடிகாரங்களில் பயன்படும் பட்டன் மின்சேமிப்புக் கலன்கள் பின்வருமாறு செயல்புரிகின்றன.
Zn (s) + Ag2O (s) + H2O (l) = 2Ag (s) + Zn2+ (aq) +
2OH– (aq) E° = 0.76V
Ag2O (s) + H2O
(l) + 2e – → 2Ag (s) + 2 OH– (aq) E° = 0.34 V எனில் மின்கல மின்னழுத்தம்
நேர்மின்வாய் ஆக்சிஜனேற்றம் 0 (E°ox) = 0.76 V கொடுக்கப்பட்ட வினையின் எதிர்வினை
E°cell = (E°ox)
+ (E°red)
= 0.76 + 0.34 = 1.1 V
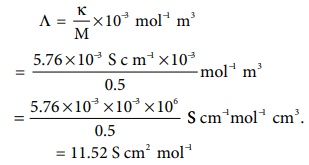

அளவிலா நீர்த்தலில், 25°C வெப்பநிலையில், மின் பகுளிகளின் மோலார் கடத்துத்திறன் மதிப்புகள் மேலேயுள்ள அட்டவணையில் கொடுக்கப் பட்டுள்ளன. அவற்றிலிருந்து தகுந்த மதிப்புகளை பயன்படுத்தி Λo HOAC மதிப்பை கணக்கிடுக.
(Λ∞) HOAC = [(Λo) Hcl + (Λo)
NaOAC] – (Λo)NaCl
= (426.2 + 91) – (126.5) = 390.7
1F = 96500 C = 1 மோல் எலக்ட்ரான்களின் மின்சுமை = எலக்ட்ரானின் மின்சுமை 6.022 × 1023 e–
பின்வரும் வினை நிகழ எவ்வளவு ஃபாரடே மின்னோட்டம் தேவைப்படும்?
MnO4– → Mn2+
7Mno4– + 5e– → Mn2+ + 4H2O
தேவைப்படும் 5 மோல் எலக்ட்ரான்கள் அதாவது 5F மின்சுமை
உருகிய கால்சியம் ஆக்சைடு கரைசலின் வழியே, 3.86 A அளவுள்ள மின்னோட்டமானது, 41 நிமிடங்கள் மற்றும் 40 விநாடிகளுக்கு செலுத்தப் படுகிறது. எதிர்மின் முனையில் வீழ்படிவாகும் கால்சியத்தின் நிறை கிராமில் கணக்கிடுக. (Ca ன் அணு நிறை 40 கிராம் / மோல் மற்றும் 1F = 96500C)
m = ZIt 41 நிமிடங்கள் 40 வினாடிகள்
= 2500 வினாடிகள்
= (40 × 3.86 × 2500) / (2 × 96500)
Z = m / (n × 96500) = (40) / (2 ×
96500)
= 2g
உருகிய சோடியம் குளோரைடு மின்னாற்பகுத்தலில், 3A மின்னோட்டத்தை பயன்படுத்தி 0.1 மோல் குளோரின் வாயுவை உருவாக்க தேவைப்படும் நேரம்
m = ZIt (ஒரு மோல் Cl2 வாயுவின் நிறை =71)
t = m/ZI (ஃ
0.1 மோல் குளோரின் வாயுவின் நிறை = 7.1 g mol–1)

= 6433.33 வினாடிகள் = 107.2 நிமிடங்கள்
1A மின்னோட்டத்தை பயன்படுத்தி மின்னாற் பகுக்கும் போது 60 விநாடிகளில், எதிர்மின் முனையில் விடுவிக்கப்படும் எலக்ட்ரான்களின் எண்ணிக்கை (எலக்ட்ரானின் மின்சுமை = 1.6 x 10–19 C)
Q = It
= 1A × 60S
96500 C மின்சுமை = 6.022 × 1023 எலக்ட்ரான்
60 C மின்சுமை = [ (6.022 × 1023) / 96500 ] × 60
= 3.744 × 1020 எலக்ட்ரான்